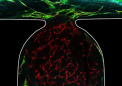
格勒诺布尔跨学科研究所 (CEA-Irig)、CEA-Leti 以及欧洲和加拿大的其他研究所和研究人员已经证明,类器官在微流控上的完全血管化速度和流速与血液相似,从而改善了功能成熟并使其能够长期生存。

类器官是自组织细胞的 3D 组装体,能够部分模仿器官或组织的不同生理特征,已被证明对于评估药物或新分子的治疗功效非常有用。但它们必须血管化以促进营养物质和氧气的交换和运输,否则它们的成熟和生长就会受到损害。在体内,这种血管化是由血流保证的。
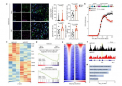
通过在体外使类器官血管化并在微流控中培养30天,研究人员观察到类器官的生长、成熟和生理功能显着改善,几乎与小鼠异种移植后观察到的效果相当。类器官研发方面的这一重大技术进步也实现了生产规模化。
这一突破发表在《自然通讯》的论文《集成功能性血管化类器官的微流体平台》中。
该论文解释道:“微流控中血管网络的发展对于球体、类器官、类肿瘤或组织外植体等三维细胞聚集体的长期培养至关重要。”
“尽管微血管网络系统和类器官技术取得了快速进步,但上类器官的血管化仍然是组织工程中的一个挑战。大多数现有的微流体装置很难反映体内流动的复杂性,并且需要复杂的技术设置。”
 新传媒网
新传媒网